اسید ضعیف چیست و انواع آن کدامند؟
تقریباً تمام اسیدهایی که در لیست اسیدهای قوی نیستند را می توان به عنوان اسید ضعیف طبقه بندی کرد. این اسیدها وقتی با آب مخلوط می شوند، نمی توانند به طور کامل به یون های خود تجزیه شوند. به عنوان مثال، اگر HF را با آب مخلوط کنید، یون های H+ و F- تولید می شوند. با این حال، اگر مقداری از یون های HF در محلول باقی بماند، نمی تواند یک اسیدقوی باشد.
فهرست مطالب
فهرست انواع اسیدضعیف پرکاربرد
از آنجایی که تنها هفت اسیدقوی اصلی در صنعت وجود دارد، لیست اسیدهای ضعیف بسیار طولانی تر از لیست اسیدهای قوی است. به طور معمول، بیشتر اسیدهای آلی در دسته اسیدهای ضعیف قرار می گیرند. در زیر لیستی از مهمترین اسید های ضعیف برای شما جمع آوری شده است.
- اسیداگزالیک (HO2C2O2H)
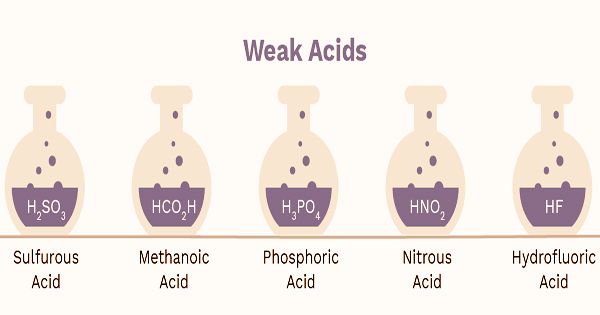
- اسیدسولفوروز (H2SO3)
- یون سولفات هیدروژن (HSO4 -)
- اسیدفسفریک (H3PO4 -)
- اسیدنیتروژن (HNO2 -)
- هیدروفلوریک اسید (HF)
- متانوئیک اسید (HCO2H)
- بنزوئیک اسید (C6H5COOH)
- اسیداستیک (CH3COOH)
- اسیدفرمیک (HCOOH)
تمام اسیدهای ضعیف فوق از قوی ترین به ضعیف ترین دسته بندی می شوند. حال، اجازه دهید به شما یک ایده مختصر در مورد اینکه چرا این اسیدها، اسیدهای ضعیف نامیده می شوند، ارائه دهیم. برای این کار، باید به تفکیک اسید اتانوئیک در آب نگاه کنیم:
CH3COOH + H2O ⇆ H3O+ + CH3COO-
اتانوئیک اسید + آب ⇆ کاتیون های هیدرونیوم + آنیون های اتانوات
در معادله بالا به وضوح می بینید که اسید اتانوئیک با مخلوط شدن با آب، کاتیون های هیدرونیوم و آنیون های اتانوات تولید می کند. با این حال، فلش واکنش ( ⇆ ) به هر دو جهت اشاره می کند. نشان می دهد که تنها حدود 1٪ از اتانوئیک اسید به یون تبدیل می شود. بقیه اسید به همان صورت باقی می ماند.
همچنین، از آنجایی که این واکنش در هر دو جهت عمل می کند و واکنش برگشتی مطلوب تر از واکنش رو به جلو است، یون ها پس از تشکیل می توانند به راحتی به اسید تبدیل شوند. در مورد اسیدهای قوی، واکنش رو به جلو مطلوب است و واکنش برگشتی وجود ندارد. از آنجایی که این یون ها بین اسید و آب رفت و آمد می کنند، اسید را تبدیل به یک اسیدضعیف می کند.
قدرت اسیدی اسیدضعیف
لطفا توجه داشته باشید که اصطلاح قوی هیچ ارتباطی با قدرت اسیدی آن ندارد و برای هر کدام از آنها متفاوت است. در واقع، استفاده از یک اسیدقوی در صورت استفاده با احتیاط و در غلظت خاصی می تواند بی خطر باشد. از سوی دیگر، برخی از اسیدهای ضعیف می توانند بدون رعایت نکات ایمنی بسیار خورنده و خطرناک باشند.
تفکیک اسیدقوی، زمانی که در آب حل می شوند، به یک واکنش شیمیایی مربوط می شوند. به عنوان مثال، وقتی به واکنش یونیزاسیون اسید کلریدریک (HCl)، یکی از هفت اسیدقوی نگاه می کنید ، به شرح زیر است:
HCl– → H+ + Cl
در واکنش بالا، می توانید ببینید که یون هیدروژن H+ و آنیون Cl- محصولات نهایی هستند. یعنی HCl در طی واکنش کاملاً یونیزه می شود. اهمیت دیگر این تفکیک این است که فقط در یک جهت پیش می رود. نتیجه می گیرد که وقتی یک اسیدقوی را یونیزه می کنید، واکنش در همان جا متوقف می شود و چنین واکنشی برگشت ناپذیر است.
اسیدقوی ممکن است همیشه قوی نباشد. همه چیز به تفکیک آنها در آب بستگی دارد. به طور معمول، اسیدهای قوی تر، غلیظ تر هستند و کمتر می توانند تجزیه شوند. وقتی نتوانند به طور کامل جدا شوند، آنقدر قوی نیستند. معمولاً یک اسید قوی را می توان به طور کامل (100%) در محلول هایی که غلظت آنها 1.0 مولار یا کمتر است تفکیک کرد.
نکات مهم هنگام کار با اسیدها
هنگام استفاده از انواع اسیدها باید نکات بسیار زیادی را رعایت کنید. اسیدها چه به صورت قوی و چه به صورت ضعیف می توانند خورنده باشند و برای سلامتی عوارض جانبی را ایجاد کنند. بنابراین هنگام استفاده از هر نوع اسید، استفاده از وسایل محافظتی مانند عینک، دستکش و ماسک توصیه می شود. همچنین در صورت تماس اسید با پوست، باید سریعا محل تماس را با آب شستشو دهید.



