تعادل شیمیایی چیست؟ | همه چیز در مورد آن
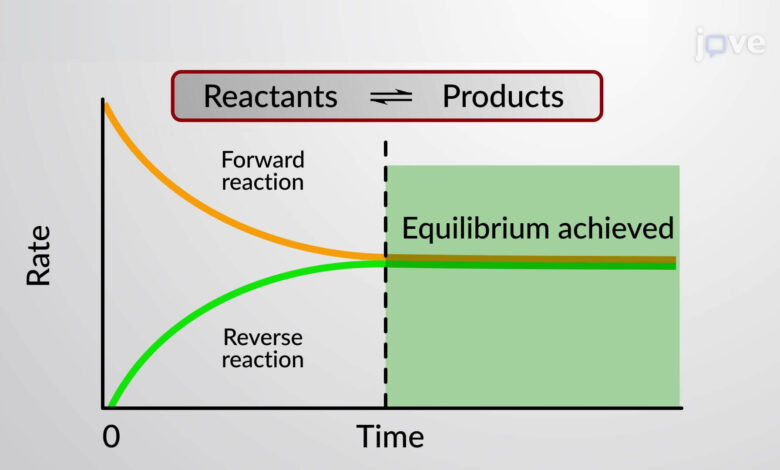
در جهان پیرامون ما در هر لحظه هزاران واکنش شیمیایی در حال انجام هستند. برخی از این واکنشهای شیمیایی کامل هستند و به تولید محصول منجر میشوند. اما برخی دیگر از واکنشهای شیمیایی هستند که تنها تا میزان معینی پیش رفته و تمام واکنشگرهای آن به محصول تبدیل نمی شوند. در این واکنش ها درواقع غلظت واکنش دهنده ها و فرآورده ها با گذشت زمان ثابت مانده و تغییری نمی کند. به این حالت از واکنش ها تعادل شیمیایی گفته می شود. جالب است بدانید در یک واکنش همراه با تعادل شیمیایی سرعت واکنش رفت و برگشت برابر است. انواع تعادل شیمیایی با عنوان های تعادل همگن و تعادل ناهمگن شناخته شده است.
در ادامه این مطلب به بررسی عوامل موثر بر تعادل شیمیایی و نحوه جابجایی آن می پردازیم. با ما همراه باشید تا بیشتر با تعادل شیمیایی این موضوع مهم در Chemistry آشنا شوید.
فهرست مطالب
تعادل شیمیایی چیست
تعادل شیمیایی حالتی از واکنش است که در آن فعالیت شیمیایی، غلظت واکنشگرها و محصولات با گذشت زمان تغییری نخواهد نمود. درواقع تعادل شیمیایی در شرایطی مشاهده می شود که سرعت واکنش رفت با سرعت واکنش برگشت برابر باشد.
براساس ترمودینامیک در تعادل شیمیایی تغییرات انرژی آزاد گیبس واکنش برابر با صفر است. کاهش سطح انرژی و افزایش انتروپی واکنش را در دو جهت رفت و برگشت به صورت همزمان هدایت می کند. توجه شود که در تعادل شیمیایی کاهش سطح انرژی و افزایش آنتروپی بر یکدیگر برتری ندارند. بنابراین تا زمانی که تغییری در شرایط مرزی سیستم رخ ندهد، تعادل باقی خواهد ماند.
البته اعمال تغییرات دما، حجم و فشار می تواند سامانه را از تعادل خارج کند. در این حالت واکنش در جهتی پیش میرود که بتواند تأثیرات ناشی از تغییرات اعمال شده را کاهش دهد.
خواص و نشانه های تعادل شیمیایی
این واکنش ها نشانه هایی دارند که با بررسی آن ها می توان به تعادلی بودن واکنش پی برد. در ادامه به بررسی این نشانه ها می پردازیم.
در این واکنش ها سرعت واکنش رفت با سرعت واکنش برگشت برابر است.
سیستم بسته است و هیچ مبادله جرمی با محیط ندارد.
خواص ماکروسکوپی مانند غلظت، رنگ و… بدون تغییر هستند.
سیستم در سطح میکروسکوپی پویا است. این بدان معناست که واکنش رفت و برگشت در سطح مولکولی مدام در حال انجام است.
انواع تعادل شیمیایی
تعادلات شیمیایی را می توان به دو دسته تقسیم بندی نمود.
تعادل همگن
در تعادل های همگن واکنش دهنده ها و فرآورده ها و تمام مواد مورد استفاده در واکنش در یک فاز قرار دارند.
تعادل ناهمگن
در تعادل ناهمگن مواد شرکت کننده در واکنش تعادلی در فازهای متفاوتی قرار دارند. برای نمونه ای از یک تعادل ناهمگن دو فازی می توان به واکنش تجزیه گرمایی کربنات کلسیم جامد اشاره نمود.
عوامل موثر بر تعادل
عوامل مختلفی بر واکنش های تعادلی موثر هستند. درواقع با کنترل این عوامل می توان واکنش های تعادلی را کنترل نمود.
غلظت
تغییر در غلظت واکنش دهنده ها یا محصولات موجب تغییر در ترکیب مخلوط شده و تعادل شیمیایی تغییر خواهد کرد.
تغییر فشار
تغییرات فشار اثر متفاوتی بر سیستم های گازی نسبت به سیستم های مایع و جامد دارد. این تغییر فشار در سیستم های گازی به معنای تغییر در حجم است. در سیستم های گازی با تغییر فشار تعداد کل واکنش دهنده ها و محصولات تغییر خواهد نمود. توجه شود که تغییر فشار در تعادل های ناهمگن در سیستم های مایعات و جامدات بر طبق اصل لوشاتلیه در نظر گرفته نمی شود.
تغییر دما
تاثیرات دمایی در تعادل شیمیایی تحت تاثیرعلامت آنتالپی قرار دارد. برای مثال با کاهش دما، ثابت تعادل در یک واکنش گرماگیر کاهش و در یک واکنش گرمازا افزایش می یابد. در این حالت سرعت واکنش هم تحت تاثیر دما قرار دارد.
کاتالیزور
کاتالیزورها تنها سرعت واکنش را افزایش خواهند داد. بنابراین بر تعادل شیمیایی تاثیری نداشته و تنها موجب به تعادل رسیدن سریع تر واکنش می شوند.
گاز های بی اثر
اگر گاز های بی اثر مانند آرگون به حجم ثابتی اضافه گردند، در واکنش شرکت نخواهد کرد. بنابراین نمی توانند تاثیری بر تعادل داشته باشند.
با توجه به مواردی که در بالا اشاره شد، غلظت، دما و فشار عوامل موثر بر تعادل شیمیایی هستند.
کاربرد تعادل شیمیایی
در فرایندهای صنعتی مختلفی از تعادل شیمیایی بهره برده می شود. تهیه آمونیاک با فرایند هابر نمونه ای از واکنش های تعادلی محسوب می شود. در این واکنش با ترکیب نیتروژن و هیدروژن، آمونیاک تولید می گردد. بازده تولید آمونیاک در این واکنش با کاهش دما، افزایش فشار و حضور آهن به عنوان کاتالیزور افزایش خواهد یافت. واکنش های تعادلی در chemistry جایگاهی ویژه دارند.



